Quá trình đẳng nhiệt chính là quá trình biến đổi trạng thái khi nhiệt độ không đổi. Để hiểu hơn về quá trình đẳng nhiệt, chúng ta hãy theo dõi bài viết dưới đây của chúng tôi nhé! Bài viết cũng chỉ ra được những định luật liên quan đến quá trình này. Hãy cùng theo dõi!
Trạng thái và quá trình biến đổi trạng thái
Trạng thái của một lượng khí được xác định qua 3 thông số. Bao gồm áp suất P, thể tích V, nhiệt độ tuyệt độ T. Đây là những thông số trạng thái của chất khí. Giữa các thông số trạng thái của một lượng khí có những mối liên hệ xác định.
Trong các quá trình tự nhiên, 3 thông số trên đều sẽ thay đổi. Chỉ cần một trong ba thông số thay đổi thì trạng thái khí sẽ thay đổi. Quá trình thay đổi các thông số trạng thái được gọi là quá trình biến đổi trạng thái khí. Trường hợp 2 thông số biến đổi còn 1 thông số giữ nguyên vẫn diễn ra. Đó là quá trình đẳng nhiệt.
Quá trình đẳng nhiệt
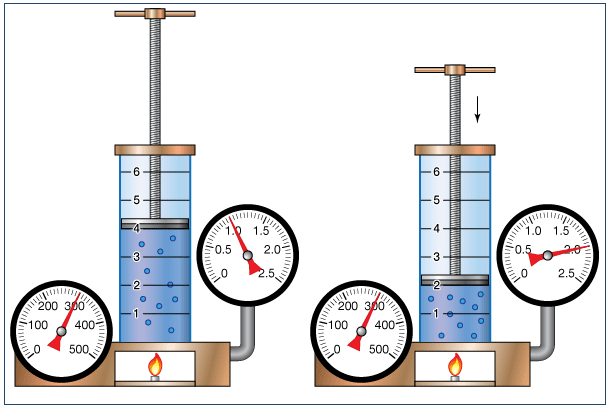
Quá trình biến đổi trạng thái trong đó nhiệt độ được giữ không đổi gọi là quá trình đẳng nhiệt.
Định luật Bôi-lơ Ma-ri-ốt
Trong quá trình đẳng nhiệt của một lượng khí nhất định. Áp suất sẽ tỉ lệ nghịch với thể tích. Hay nói 1 cách khác, ở nhiệt độ không đổi, thì tích của áp suất và thể thích một lượng khí cũng không đổi.
Đường đẳng nhiệt
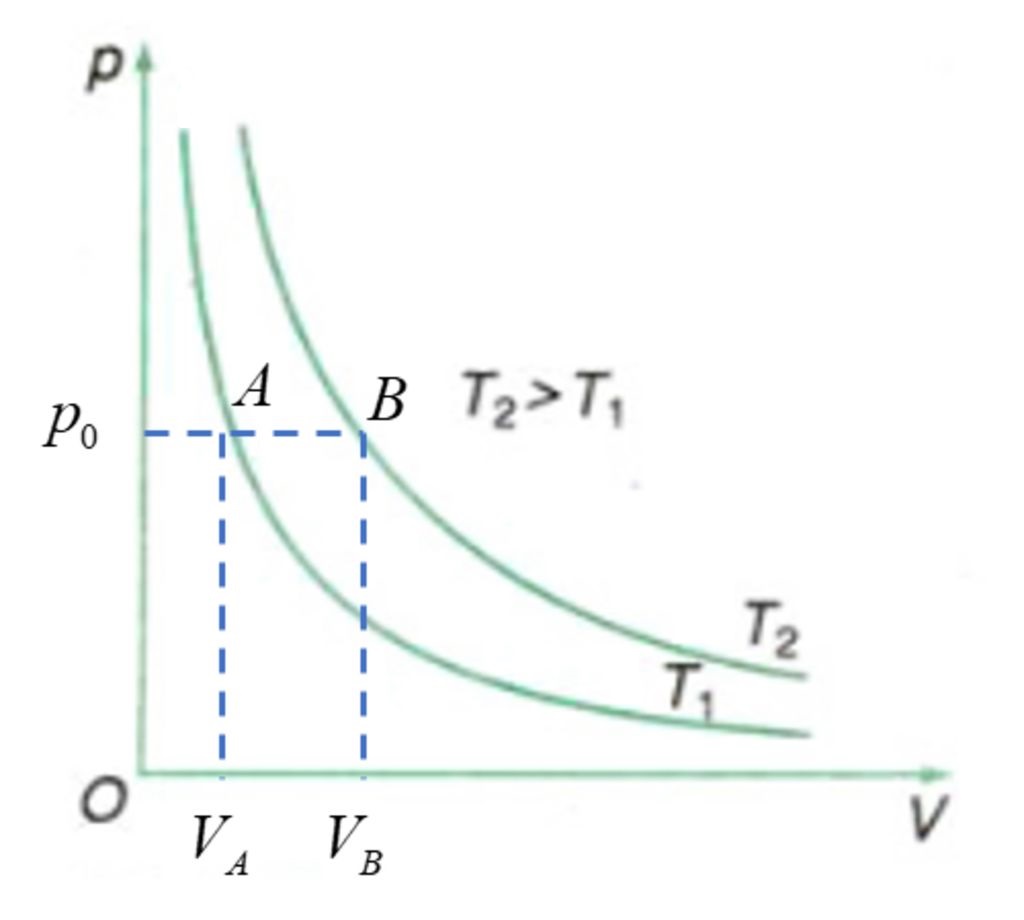
- Đường biểu diễn sự biến thiên của áp suất của một lượng khí theo thể tích gọi là đường đẳng nhiệt.
- Trong hệ toạ độ (p, V), đường đẳng nhiệt là đường hypebol.
- Đường đẳng nhiệt ở trên ứng với nhiệt độ cao hơn đường đẳng nhiệt ở dưới.
Bài viết là những thông tin liên quan đến đường đẳng nhiệt và định luật bôi-lơ-ma-ri-ốt đầy đủ nhất. Hy vọng rằng với những chia sẻ trên đây sẽ đem đến cho các bạn nhiều kiến thức bổ ích.






